Infarctus du myocarde IDM
| Cardiologie |
Infarctus du myocarde IDM
Épidémiologie :
1- Prévalence : La fréquence de l’infarctus varie considérablement selon le sexe, l’âge, le pays, les habitudes alimentaires.
En raison de la protection hormonale, l’infarctus est beaucoup plus rare chez la femme avant 70 ans. Sur le plan géographique il existe un gradient nord-sud de fréquence décroissante (variant de 1 à 5), souvent corrélé à l’indice socio-économique et aux habitudes nutritionnelles.
L’infarctus reste cependant une affection grave. On estime qu’il est responsable chaque année, en France, de 5 000 décès en préhospitalier et de 7 000 décès pendant la période hospitalière.
L’amélioration du pronostic a surtout porté sur la mortalité hospitalière qui, de 25-30 % dans les années 1960, est tombée à 18 % dans les années 1980 grâce à la diffusion des unités de soins intensifs puis à 5-10 % depuis l’extension des méthodes de reperfusion coronaire.
2- Facteurs de risque : Ce sont ceux de l’athérosclérose coronaire.
Les 3 facteurs majeurs sont l’hypercholestérolémie, l’hypertension et le tabagisme, auxquels il faut ajouter le diabète, l’obésité, l’hypertriglycéridémie, l’hyperuricémie, la sédentarité, le stress, la personnalité psychologique de type A, des facteurs de thrombose et de la coagulation.
Les facteurs de risque non modifiables sont : l’âge, le sexe masculin et l’hérédité.
Physiopathologie :
L’infarctus ou nécrose est la mort des cellules myocardiques secondaire à l’occlusion d’une artère coronaire.
1- Mécanisme princeps :
• Une thrombose coronaire occlusive est à l’origine de l’infarctus dans plus de 90 % des cas.
Cette thrombose cruorique est secondaire à la rupture d’une plaque d’athérome riche en lipides, comportant un noyau athéromateux mou surmonté d’une chappe fibreuse fine et fragile.
La matrice sous-endothéliale ainsi exposée aux éléments sanguins déclenche une réponse thrombogène dont le phénomène initial est une aggrégation plaquettaire. La rupture concerne le plus souvent des plaques jeunes, peu saillantes dans la lumière coronaire.
Ceci explique que l’infarctus soit dans un tiers des cas l’événement inaugural de la maladie coronaire.
Dans un autre tiers des cas, il survient chez un angineux stable. Dans le dernier tiers des cas, il est la complication d’un angor instable qui relève du même mécanisme de rupture mais avec une thrombose initialement non occlusive.
• Les autres mécanismes à l’origine d’un infarctus sont beaucoup plus rares : spasme sur coronaires saines ou peu lésées, embolie coronaire, dissection coronaire.
2- Conséquences de l’occlusion coronaire :
• Si l’occlusion se prolonge, l’ischémie aiguë conduit à la nécrose qui progresse des couches sous-endocardiques vers les couches sous-épicardiques et du centre de la zone irriguée par l’artère occluse vers sa périphérie.
L’ischémie aiguë peut entraîner une fibrillation ventriculaire, expliquant la fréquence de la mort subite comme mode révélateur de l’infarctus.
• La mort des cellules myocardiques est à l’origine de la libération dans la grande circulation d’enzymes plus ou moins spécifiques du myocarde qui sont à la base du diagnostic biologique.
• La nécrose se traduit par une perte de la fonction contractile (akinésie) irréversible.
Lorsqu’une reperfusion coronaire survient avant que la nécrose soit complète, une partie du myocarde retrouve sa fonction contractile mais la récupération est souvent lente (phase de sidération myocardique).
• Le remodelage ventriculaire gauche fait suite à la phase d’akinésie initiale.
Durant les 15 premiers jours, la phase d’expansion se traduit par une dilatation de la zone infarcie avec élongation et amincissement pariétal qui expose à la rupture précoce, puis secondairement à la formation d’un anévrisme. Lorsque le phénomène d’expansion est important, la dilatation peut se poursuivre les mois suivants et toucher l’ensemble de la cavité ventriculaire.
3- Facteurs influençant la taille de l’infarctus :
• La nécrose sera plus importante si le siège de l’occlusion est proximal et si l’artère concernée est l’interventriculaire antérieure.
À l’inverse, la nécrose sera moins étendue s’il existe une circulation collatérale ou si des phénomènes d’ischémie sévère ont précédé l’occlusion définitive (préconditionnement myocardique).
• L’élément majeur est la durée de l’occlusion coronaire : expérimentalement, le pourcentage de myocarde récupérable après reperfusion diminue très rapidement après la première demi-heure d’occlusion, la nécrose étant complète à la 6e heure.
Ce délai est allongé en cas de circulation collatérale, de préconditionnement myocardique et par les médicaments qui diminuent la consommation en oxygène du myocarde.
Ainsi, les essais cliniques ont montré qu’une reperfusion coronaire restait bénéfique jusqu’à la 12e heure.
Cependant, la réduction de la taille de la nécrose, la prévention de la dysfonction ventriculaire gauche et la diminution de la mortalité qui en découle seront d’autant plus importantes que la reperfusion a été précoce.
Diagnostic de l’infarctus non compliqué :
Une douleur angineuse prolongée résistant à la trinitrine sublinguale doit évoquer un infarctus du myocarde.
Tout coronarien avéré (et sans doute tout individu à risque) devrait être prévenu de cette éventualité qui impose un seul geste logique : l’appel téléphonique du SAMU.
En effet, l’association d’une douleur évocatrice et de signes électrocardiographiques d’ischémie transmurale suffit pour décider de rouvrir l’artère coronaire occluse : thrombolyse débutée sur place ou transfert vers un centre d’angioplastie.
En aucun cas on attendra la confirmation biologique de la nécrose (élévation des enzymes myocardiques) pour prendre une telle décision.
1- Interrogatoire :
Il fait préciser les caractères de la douleur et rechercher une contre-indication à la thrombolyse.
L’heure de survenue de l’infarctus est importante pour la décision thérapeutique. Lorsque la douleur a évolué par paroxysmes, on retiendra le début de la dernière douleur prolongée.
Dans les formes atypiques, un antécédent d’angor ou la présence de facteurs de risque aide au diagnostic.
• La douleur dans sa forme typique est une douleur angineuse (constrictive, rétrosternale avec éventuellement irradiation brachiale, cervicale, interscapulaire) particulière par sa survenue en dehors de l’effort, son intensité, sa durée prolongée (> 20 min), sa résistance à la trinitrine, son caractère angoissant et les signes d’accompagnement tels que sueurs, lipothymie, nausées.
• Les formes atypiques sont fréquentes : sensation de brûlure, localisation latéro-thoracique ou limitée à une irradiation, simple gêne précordiale.
La forme pseudo-digestive associant douleur épigastrique et vomissements égare volontiers le diagnostic.
Les formes indolores représentent près de 20 % des infarctus et touchent notamment les sujets âgés et les diabétiques.
Le mode de révélation peut être une asthénie inexpliquée ou une complication de l’infarctus.
Certains infarctus passent totalement inaperçus et ne sont diagnostiqués que lors d’un électrocardiogramme.
2- Examen clinique :
Il est en règle normal dans l’infarctus non compliqué. Une tendance à l’abaissement de la pression artérielle et à la tachycardie est habituelle.
La température est normale à ce stade (elle s’élèvera modérément à la 24e heure).
L’examen recherche une autre localisation de la maladie athéroscléreuse.
Il sert surtout à dépister une complication débutante et à éliminer une autre affection lorsqu’un doute diagnostique subsiste.
3- Électrocardiogramme :
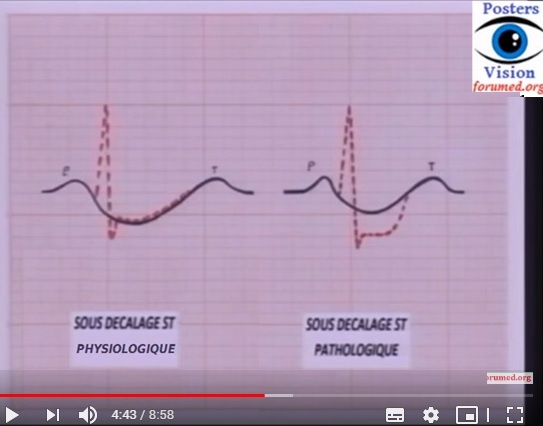
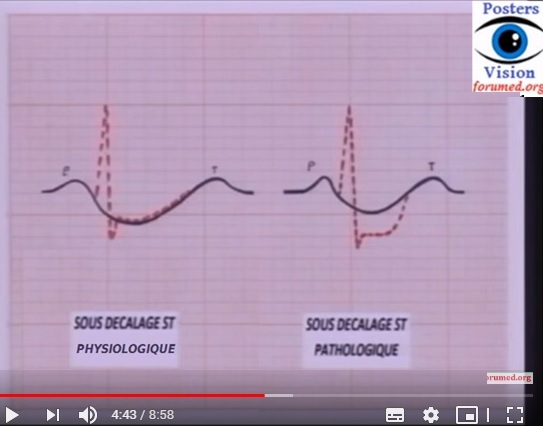
• L’ischémie sous-endocardique (onde T positive ample et pointue) est un signe très précoce (1re heure) et transitoire.
• Le signe essentiel, signant le caractère transmural de l’ischémie, est la lésion sous-épicardique : susdécalage du segment ST convexe vers le haut, pouvant englober l’onde T (onde de Pardee).
Associé à une douleur angineuse trinitro-résistante datant de moins de 12 heures, ce signe suffit à décider une reperfusion lorsque le sus-décalage de ST atteint au moins 1 mm dans les dérivations frontales, 2 mm dans les dérivations précordiales et touche au moins 2 dérivations contiguës d’un même territoire.
En fonction des dérivations intéressées, la topographie de l’infarctus est dite antérieure, inférieure, latérale ou étendue.
Des signes en miroir (sous-décalage de ST dans le territoire diamétralement opposé à celui de l’infarctus) sont présents 2 fois sur 3 dans les nécroses inférieures et 1 fois sur 2 dans les nécroses antérieures.
• Un bloc de branche gauche masque le diagnostic d’infarctus : dans ce cas, la seule douleur thoracique doit suffire, lorsqu’elle est typique, à prendre la décision d’une revascularisation myocardique.
• L’onde Q de nécrose n’apparaît habituellement qu’à partir de la 6e heure.
Pour être significative, elle doit être large (O 0,04 s) et profonde (amplitude au moins égale au tiers de celle de l’onde R).
Dans 30 % des cas, l’onde Q apparaît précocement (dès la 2e heure) mais ne doit en aucun cas faire récuser la revascularisation.
L’onde Q peut être remplacée par le seul rabotage de l’onde R.
• Parfois, les signes électrocardiographiques sont absents ou discrets.
Cependant, toute douleur typique doit conduire à l’hospitalisation en unité de soins intensifs afin d’éliminer formellement le diagnostic d’infarctus.
Il n’est pas rare, en effet, que les signes électrocardiographiques apparaissent dans les heures voire les jours suivants.
• Dans environ 20 % des cas, l’infarctus se traduit par une lésions sous-endocardique (sous-décalage du segment ST) isolée.
L’élévation enzymatique, en règle modérée, fera porter le diagnostic d’infarctus sousendocardique (infarctus non transmural, sans onde Q).
4- Diagnostic biologique :
• Classiquement, le diagnostic d’infarctus repose sur la créatine phosphokinase (CPK) lorsque sa valeur dépasse le double de la limite supérieure de la normale.
Les CPK s’élèvent à partir de la 4e heure, avec un maximum à la 24e heure (ou plus tôt en cas de reperfusion) et se normalisent au 4 e jour.
• Compte-tenu d’une spécificité faible, il faut doser la fraction CK-MB et surtout la troponine T ou I qui sont à la fois sensibles et spécifiques.
L’élévation de la troponine débute à la 4e heure, présente un maximum à la 24e heure, puis un plateau sur 5 jours suivi d’une décroissance lente jusqu’au 10e jour.
La myoglobine est très sensible mais peu spécifique.
Son dosage est surtout intéressant pour éliminer un infarctus très récent (< 2 heures).
5- Examens d’appoint :
• L’échocardiogramme n’est pas indispensable en urgence dans les formes non compliquées.
À ce stade précoce, il montre une akinésie dans le territoire de la nécrose et une hyperkinésie des autres parois.
Il est surtout intéressant lorsqu’un doute diagnostique persiste.
• Outre le dosage enzymatique, le prélèvement sanguin initial inclura numération formule sanguine, paramètres de la coagulation (TCA, INR, plaquettes, fibrinogène), glycémie, créatininémie et ionogramme sanguin.
Ces examens n’aident pas au diagnostic mais serviront de référence pour la surveillance du traitement et le dépistage de certaines complications.
Un bilan lipidique complet n’est pas inutile, dans la mesure où l’infarctus abaisse les valeurs des différentes fractions à partir de la 24 e heure.
On évitera les gaz du sang chaque fois qu’une thrombolyse est envisagée.
• Une radiographie thoracique de face, faite au lit, servira d’examen de référence.
Elle ne sera pas répétée en l’absence de complications.
6- Diagnostic différentiel :
En présence d’une douleur angineuse prolongée, 3 autres diagnostics doivent être évoqués en priorité : la dissection aortique, l’embolie pulmonaire et la péricardite aiguë.
• Dissection aortique : notion d’hypertension artérielle, douleur migratrice, souffle diastolique, asymétrie des pouls, électrocardiogramme en règle normal, élargissement du médiastin sur la radiographie de thorax ; confirmation par échographie transoesophagienne.
• Embolie pulmonaire : terrain favorisant (alitement, chirurgie récente, plâtre…), notion de phlébite, dyspnée contrastant avec une auscultation pulmonaire normale et l’absence d’opacité radiologique, signes électrocardiographiques de coeur pulmonaire aigu, effet shunt à la gazométrie, dilatation des cavités droites à l’échocardiographie, défect systématisé à la scintigraphie pulmonaire ; confirmation par visualisation d’un caillot.
• Péricardite aiguë : douleur majorée à l’inspiration et au décubitus, fièvre, contexte grippal, frottement péricardique, sus-décalage de ST diffus (absence d’image en miroir), parfois cardiomégalie, syndrome inflammatoire biologique ; confirmation par échocardiogramme.
• L’angor de Prinzmetal associe douleur angineuse et sus-décalage de ST.
Habituellement réversible sous trinitrine, il peut néanmoins évoluer vers l’infarctus lorsque le spasme coronaire se prolonge.
Évolution de l’infarctus non compliqué :
1- Séjour en unité de soins intensifs :
Une surveillance initiale en unité de soins intensifs est indispensable pour dépister les complications qui prédominent les premiers jours.
• La surveillance clinique recherche par l’interrogatoire une récidive douloureuse, une dyspnée ou des palpitations.
La fréquence cardiaque et la pression artérielle sont mesurées toutes les heures et plus fréquemment lors de l’instauration d’un traitement.
Un examen clinique biquotidien recherche l’apparition d’un souffle cardiaque, d’un frottement péricardique ou d’un bruit de galop, une insuffisance cardiaque, une phlébothrombose des membres inférieurs, une complication hémorragique après thrombolyse.
La diurèse est mesurée quotidiennement.
• Le dépistage des troubles du rythme et de la conduction se fait grâce à la surveillance permanente de l’électrocardiogramme au niveau d’une centrale équipée d’une mémoire et d’une alarme sonore avec déroulement automatique du tracé.
• Un électrocardiogramme complet est réalisé plusieurs fois le premier jour puis quotidiennement.
L’évolution normale se fait vers la régression plus ou moins rapide du sus-décalage de ST en même temps que l’onde T s’aplatit puis se négative (ischémie sous-épicardique) et que l’onde Q se creuse sur quelques jours. Habituellement définitive, elle signe la séquelle de l’infarctus.
L’onde T se normalisera progressivement en quelques semaines.
• La surveillance biologique est réduite au minimum dans cette forme non compliquée.
Le dosage des enzymes myocardiques toutes les 6 heures le 1er jour puis quotidien les 2 jours suivants sert à déterminer le pic enzymatique.
Lorsqu’une héparinothérapie efficace est nécessaire, le temps de céphaline activé (TCA) est contrôlé toutes les 6 heures le 1er jour puis quotidiennement. L’héparinothérapie impose la recherche d’une thrombopénie tous les 4 jours.
• Le syndrome de reperfusion myocardique après thrombolyse ou angioplastie : dans sa forme complète, il associe la disparition brutale de la douleur et du susdécalage de ST, des troubles du rythme ventriculaire transitoires en règle bénins (le plus souvent rythme idio-ventriculaire accéléré), un pic enzymatique précoce (avant la 14e heure pour les CPK) lié à un effet de lavage lors du rétablissement du flux sanguin dans la coronaire.
Si ces différents signes ont une bonne spécificité, ils sont malheureusement peu sensibles.
L’absence de critère fidèle de reperfusion conduit certains à réaliser une coronarographie systématique dans les suites immédiates d’une thrombolyse en vue d’une angioplastie dite de sauvetage si l’artère est restée occluse.
• En l’absence de complication, le lever est autorisé dès le 3e jour et le patient peut quitter les soins intensifs.
2- Bilan à visée pronostique :
Il doit être fait avant la fin de l’hospitalisation (8e-10e jour).
On sait en effet que la moitié des décès de la première année survient dans les 2 premiers mois.
Ce bilan a pour but de dépister les malades menacés d’une insuffisance cardiaque, de récidives ischémiques et de troubles du rythme ventriculaire.
• L’étude de la fonction ventriculaire gauche se fait par échocardiographie : appréciation de l’étendue de la zone akinétique et de la contractilité des autres parois, mesure des diamètres, des volumes et de la fraction d’éjection (FE).
Le degré de dilatation ventriculaire et l’altération de la FE sont les meilleurs facteurs pronostiques du postinfarctus.
Chez un patient peu échogène, l’angioscintigraphie cavitaire permet de mesurer la fraction d’éjection..
• L’instabilité électrique prédispose aux troubles du rythme ventriculaire.
– L’enregistrement Holter de 24 heures retrouve fréquemment des extrasystoles ventriculaires (ESV) qui ne justifient pas un traitement particulier lorsqu’elles sont asymptomatiques et sans critère de gravité. Parfois, il existe des ESV dites complexes, à savoir polymorphes ou répétitives (doublet, triplet, tachycardie ventriculaire non soutenue) ou à couplage court (phénomène R/T).
Bien que cette extrasystolie ventriculaire ait une valeur pronostique péjorative indéniable, il importe surtout de dépister et de traiter une ischémie résiduelle ainsi que la dysfonction ventriculaire gauche qui lui sont souvent associées.
– L’électrocardiogramme moyenné à haute amplification recherche à partir du 10e jour la présence de potentiels tardifs, c’est-à-dire une activité électrique anormale située à la fin du complexe QRS qui correspond à une zone de fibrose responsable d’une conduction lente favorisant les phénomènes de réentrée.
Cet examen est rassurant lorsqu’il est négatif.
La présence de potentiels tardifs augmente le risque de survenue d’une tachycardie ventriculaire mais sa valeur prédictive est assez faible.
• La recherche d’une ischémie résiduelle est un temps fondamental du bilan à visée pronostique. Elle se fera par électrocardiogramme d’effort réalisé à partir du 8e jour sans interrompre le traitement.
Un test négatif pour un bon niveau d’effort autorise la sortie du patient mais il devra être répété dans les mois suivants, et cette fois-ci démaquillé.
Un test est dit positif lorsqu’il s’accompagne d’une douleur et (ou) d’un sous-décalage du segment ST horizontal ou descendant, supérieur ou égal à 1 mm.
Les critères de mauvais pronostic sont l’absence d’élévation tensionnelle à l’effort, l’apparition précoce du sous-décalage de ST, sa normalisation très lente après l’arrêt de l’effort, l’importance du sous-décalage.
L’électrocardiogramme d’effort n’a pas de valeur localisatrice de l’ischémie.
La scintigraphie myocardique au thallium couplée à l’effort ou à l’injection de dipyridamole a une sensibilité et une spécificité supérieures à celles de l’électrocardiogramme d’effort.
La nécrose est responsable d’un défect non réversible au repos.
L’ischémie se définit par une hypofixation du traceur à l’effort, réversible au repos.
L’examen permet de localiser et de quantifier l’ischémie.
Les paramètres de mauvais pronostic sont une fixation pulmonaire du thallium et une ischémie étendue à plusieurs territoires.
Dans environ un tiers des cas, le caractère fixe du défect scintigraphique ne correspond pas à la nécrose mais à une ischémie profonde susceptible de régresser après revascularisation coronaire (hibernation myocardique).
La viabilité myocardique doit alors être mise en évidence par échographie de stress (perfusion de dobutamine) qui montre un potentiel contractile de cette zone.
• La coronarographie : l’opacification des coronaires ne dépiste pas l’ischémie.
En tant qu’examen invasif, il ne peut être considéré comme totalement anodin.
Il apporte cependant des renseignements importants concernant le résultat de la thrombolyse et la diffusion des lésions coronaires.
Une sténose du tronc de la coronaire gauche ou une atteinte tritronculaire constituent des éléments de mauvais pronostic, ce d’autant qu’il s’y associe une altération de la fonction ventriculaire gauche appréciée à l’angiographie faite dans le même temps.
Les indications certaines de la coronarographie sont la récidive angineuse, l’insuffisance cardiaque ou la dysfonction ventriculaire gauche (FE < 40 %), l’ischémie myocardique dépistée par électrocardiogramme d’effort ou scintigraphie myocardique, l’impossibilité de réaliser un test d’effort ou son caractère ininterprétable.
Pour certains, la coronarographie doit être systématique, mais son principal inconvénient réside dans la tentation d’y associer une angioplastie au niveau de la sténose résiduelle de l’artère responsable de l’infarctus.
Il est démontré qu’une telle attitude est inutile voire délétère lorsque l’artère est perméable et qu’il n’y a pas d’ischémie résiduelle authentifiée.
Complications :
Les plus fréquentes sont les récidives ischémiques, l’insuffisance cardiaque gauche et les troubles du rythme ventriculaire.
1- Complications ischémiques :
• Une récidive ischémique dans le territoire de l’infarctus signe la réocclusion coronaire qui peut survenir dans les heures ou jours qui suivent une reperfusion réussie.
Elle se traduit par la réapparition de la douleur associée à une réascension du segment ST.
L’intensification du traitement antithrombotique et anti-angineux (nitré, inhibiteur calcique en plus du traitement bêtabloquant), ne doit pas retarder la réalisation d’une coronarographie qui débouchera sur une angioplastie ou, plus rarement, un pontage aorto-coronaire.
Cette récidive ischémique peut évoluer vers une nouvelle nécrose (réascension enzymatique, creusement de l’onde Q) si la revascularisation n’est pas effectuée rapidement.
Une telle éventualité justifie le transfert des patients thrombolysés vers un centre capable de faire une angioplastie en urgence, tout au moins lorsque l’infarctus initial paraît étendu sur le plan électrocardiographique.
Il n’est pas rare que la réocclusion coronaire se fasse à bas bruit, voire même de façon totalement silencieuse, marquée par une repositivation brutale de l’onde T ou une majoration du susdécalage de ST.
• Une récidive angineuse associée à des modifications électriques dans un territoire différent de celui de l’infarctus traduit une menace d’extension.
Ce tableau requiert la coronarographie en urgence et une revascularisation qui sera souvent chirurgicale en raison de la diffusion des lésions coronaires.
2- Insuffisance cardiaque par altération de la fonction contractile ventriculaire gauche :
C’est une complication fréquente, précoce ou tardive, qui peut réaliser tous les tableaux depuis les râles crépitants isolés chez un patient asymptomatique jusqu’au choc cardiogénique.
• Le choc cardiogénique associe tachycardie, hypotension artérielle, oedème pulmonaire et signes d’hypoperfusion périphérique (extrémités froides, marbrures, chute de la diurèse).
L’échocardiographie en urgence permet d’éliminer une rupture septale ou une insuffisance mitrale aiguë et retrouve le plus souvent une altération très importante de la fonction contractile ventriculaire gauche, des signes de bas débit et une hypertension artérielle pulmonaire.
Le traitement conventionnel basé sur les sympathomimétiques intraveineux (dobutamine, 5 à 15 eg/kg/min et dopamine, 5 eg/kg/min) n’empêche pas une mortalité supérieure à 80 %.
Lorsque l’état de choc complique la phase initiale de l’infarctus, il faut préférer l’angioplastie à la thrombolyse, la désobstruction coronaire en urgence permettant d’abaisser légèrement la mortalité.
Le choc cardiogénique peut apparaître secondairement après détérioration hémodynamique progressive chez un patient ayant en règle un infarctus étendu.
Le traitement sympathomimétique n’apporte qu’une amélioration transitoire, et l’on doit discuter, en particulier chez le sujet jeune, le transfert dans un centre de chirurgie pour mise en place d’une assistance circulatoire précédant une éventuelle greffe cardiaque.
• En dehors du choc cardiogénique, l’insuffisance cardiaque s’installe progressivement : tachycardie sinusale, dyspnée, râles crépitants à l’auscultation pulmonaire, cardiomégalie plus ou moins importante et surcharge vasculaire pulmonaire sur la radiographie thoracique.
L’auscultation cardiaque recherche un bruit de galop et vérifie l’absence de souffle systolique.
L’échocardiogramme mesure le degré de dysfonction ventriculaire gauche, évalue les pressions pulmonaires et élimine une insuffisance mitrale par dysfonction de pilier et une rupture septale.
Le traitement immédiat comprend l’oxygénothérapie nasale, l’arrêt des bêtabloquants, la prescription d’un diurétique, d’un inhibiteur de l’enzyme de conversion de l’angiotensine (IEC) et éventuellement un dérivé nitré en intraveineux.
Après stabilisation de l’état hémodynamique, la coronarographie permet d’évaluer les possibilités de revascularisation d’une part, au niveau du territoire infarci s’il existe uneviabilité myocardique (intérêt de l’échocardiographie de stress) et, d’autre part, au niveau des autres artères lorsqu’elles présentent des rétrécissements significatifs.
3- Troubles du rythme et de la conduction :
• Troubles du rythme ventriculaire.
– Les extrasystoles ventriculaires sont extrêmement fréquentes au cours des 2 premiers jours.
Leur mécanisme catécholergique justifie la prescription précoce des bêtabloquants.
Certaines sont potentiellement dangereuses, c’est-à-dire susceptibles d’initier une tachycardie ou une fibrillation ventriculaire : ESV très nombreuses, polymorphes, à couplage court (phénomène R/T) ou répétitives (O 2 ESV consécutives).
Le traitement repose alors sur la Xylocaïne en perfusion de 1 à 2 g/24 h pendant 1 à 2 jours.
– Le rythme idioventriculaire accéléré réalise un rythme régulier d’origine ventriculaire (QRS larges) dont la fréquence est comprise entre 60 et 130/min.
Il traduit souvent une reperfusion coronaire.
Bien toléré et transitoire, il ne requiert aucun traitement.
– La tachycardie ventriculaire (TV) soutenue réalise un rythme régulier à QRS larges dont la fréquence est supérieure à 130/min.
Souvent d’emblée mal tolérée (chute tensionnelle, insuffisance cardiaque), elle doit être réduite rapidement par choc électrique externe sous anesthésie générale légère.
Lorsque la tolérance est bonne, le mode de réduction idéal est la stimulation ventriculaire endocavitaire.
En effet, les antiarythmiques par voie intraveineuse sont tous dépresseurs de la fonction myocardique.
La Xylocaïne est peu toxique mais rarement efficace pour réduire une tachycardie ventriculaire soutenue.
On peut utiliser l’amiodarone, soit en dose de charge orale, soit en injection intraveineuse très lente (150 à 300 mg en 30 min) en surveillant étroitement l’état hémodynamique.
En cas d’échec, il faut recourir au choc électrique externe.
Après retour du rythme sinusal, le relais sera pris par la Xylocaïne en perfusion continue.
– La fibrillation ventriculaire (FV) est responsable d’un arrêt cardio-circulatoire avec état de mort apparente cependant que l’électrocardiogramme montre une activité anarchique et rapide des complexes QRS larges.
Si le premier geste à faire est le massage cardiaque externe, seul le recours le plus rapide possible au choc électrique externe permet de sauver le patient.
Après retour en rythme sinusal, la prévention des récidives est assurée par la Xylocaïne.
Des récidives très rapprochées de fibrillation ventriculaire, ayant nécessité plusieurs chocs, doivent conduire à une oxygénothérapie intensive après intubation et ventilation assistée, associée à l’alcalinisation, et éventuellement l’adrénaline avant de répéter les chocs électriques.
– Le pronostic ultérieur des troubles du rythme ventriculaire survenus lors des premiers jours de l’infarctus, est habituellement bon et ne requiert aucun traitement.
Il n’en est pas de même des tachycardies ventriculaires-fibrillations ventriculaires (TV-FV) survenant après la phase aiguë.
Après avoir éliminé une ischémie myocardique relevant d’un geste de revascularisation, on proposera à ces patients un défibrillateur implantable qui s’est montré supérieur aux médicaments antiarythmiques.
Parmi ceuxci, seuls les bêtabloquants et la classe III (amiodarone, sotalol) peuvent être utilisés, en vérifiant leur efficacité par stimulation ventriculaire programmée et enregistrement Holter.
Il faut éviter les antiarythmiques de classe I qui se sont montrés délétères dans le postinfarctus.
• Troubles du rythme supraventriculaire
– La bradycardie sinusale n’est pas rare au cours des infarctus de localisation inférieure et dans le cadre du syndrome de reperfusion.
Elle traduit une réaction vagale et ne sera traitée que s’il existe une hypotension symptomatique : injection intraveineuse de 1 mg d’atropine, surélévation des membres inférieurs et si nécessaire remplissage.
– L’arythmie complète par fibrillation auriculaire survient dans les infarctus étendus à l’oreillette et en cas de réaction péricardique inflammatoire.
Son traitement repose sur l’anticoagulation, les digitaliques pour ralentir la fréquence cardiaque et les diurétiques en cas d’insuffisance cardiaque.
Dans les rares cas de très mauvaise tolérance hémodynamique, on aura recours d’emblée au choc électrique.
Le plus souvent, le trouble du rythme disparaît spontanément en quelques heures ou quelques jours.
Dans le cas contraire, on pourra tenter une réduction médicamenteuse (amiodarone per os) ou un choc électrique.
• Blocs auriculo-ventriculaires (BAV) : la signification pronostique d’un BAV complet varie selon la localisation de l’infarctus.
– Dans les infarctus inférieurs, le BAV est de siège nodal et le plus souvent bien toléré car le rythme d’échappement jonctionnel (QRS fin) est voisin de 50 à 60/min.
Le rythme s’accélère sous atropine, et il est rare qu’on ait besoin de recourir à une sonde d’entraînement.
Le BAV disparaît en quelques jours et n’influe pas sur le pronostic ultérieur.
– Dans les infarctus antérieurs, les BAV sont devenus rares en même temps que se généralisent les stratégies de revascularisation.
Parfois précédé de l’apparition d’un bloc de branche, le BAV complet est toujours mal toléré, avec un rythme d’échappement ventriculaire (QRS large) lent (< 40/min) nécessitant l’électrostimulation en urgence, qui sera transitoire ou définitive (implantation d’un pace-maker).
Le pronostic reste très réservé car ces BAV compliquent des infarctus en règle très étendus.
Classiquement, l’apparition d’un bloc de branche (surtout bloc de branche gauche ou bloc de branche droit associé à un hémibloc gauche) justifie la mise en place prophylactique d’une sonde d’entraînement.
En fait, cette attitude est controversée.
4- Ruptures :
• Rupture de la paroi libre du ventricule gauche : cause non négligeable de décès hospitaliers, elle complique surtout les infarctus antérieurs lorsque le phénomène d’expansion est particulièrement marqué et que l’électrocardiogramme montre l’absence de régression du sus-décalage de ST.
Dans l’immense majorité des cas, la rupture est brutale et entraîne une mort subite par dissociation électromécanique : persistance d’une activité électrique normale mais disparition du pouls et de la tension.
Les manoeuvres de réanimation sont constamment inefficaces.
Dans de rares cas, la rupture est précédée d’une fissuration à l’origine d’une récidive douloureuse avec tableau de tamponnade (collapsus tensionnel, turgescence jugulaire, épanchement péricardique à l’échographie avec signes d’adiastolie), qui laisse parfois le temps d’opérer ces patients en urgence.
• Rupture de pilier mitral : elle est responsable d’une insuffisance mitrale aiguë survenant dans les jours qui suivent la nécrose.
Il s’agit le plus souvent d’une rupture du pilier postérieur compliquant un infarctus inférieur.
Le diagnostic est évoqué devant l’apparition d’un souffle holosystolique de pointe associé à un tableau d’insuffisance cardiaque gauche dont le degré est plus ou moins marqué selon que la rupture est totale ou partielle ou s’il s’agit seulement d’une dysfonction ischémique du pilier.
La rupture complète entraîne souvent un état de choc.
Le diagnostic est confirmé par échocardiographie-doppler qui montre la fuite mitrale et un mouvement anormal d’une des valves qui prolabe dans l’oreillette gauche.
La mauvaise tolérance hémodynamique malgré le traitement de l’insuffisance cardiaque doit conduire rapidement à la correction chirurgicale de l’insuffisance mitrale (plastie ou remplacement valvulaire) après avoir réalisé une coronarographie sous contrepulsion diastolique en vue d’associer une revascularisation complète par pontage.
• Rupture septale : il s’agit d’une communication interventriculaire compliquant de façon précoce un infarctus atteignant le septum.
Le diagnostic est évoqué devant l’apparition d’un souffle systolique précordial intense associé à un tableau d’insuffisance cardiaque gauche et (ou) droite plus ou moins sévère.
Le diagnostic est confirmé par échocardiographie-doppler qui montre la perforation et un flux sanguin passant du ventricule gauche au ventricule droit.
Le traitement est chirurgical : fermeture de la rupture septale et revascularisation après coronarographie préopératoire.
Le degré d’urgence dépend de la tolérance hémodynamique.
5- Infarctus du ventricule droit :
C’est l’extension au ventricule droit d’un infarctus ventriculaire gauche le plus souvent inférieur.
On doit l’évoquer devant une hypotension, voire un état de choc, associée à des signes d’insuffisance cardiaque droite (turgescence jugulaire, foie cardiaque) contrastant avec l’absence de signe clinique ou radiologique d’insuffisance cardiaque gauche.
Le signe électrocardiographique le plus spécifique est un sus-décalage du segment ST dans la dérivation V4R.
L’échocardiogramme retrouve un trouble de la cinétique du ventricule droit qui est parfois dilaté.
Il faut éviter les diurétiques et les nitrés mais au contraire assurer un remplissage efficace et maintenir une fréquence cardiaque élevée (> 80/min) au besoin par stimulation auriculo-ventriculaire séquentielle.
Le pronostic est habituellement bon.
6- Péricardite :
• Une réaction péricardique précoce, d’origine inflammatoire, est fréquente.
Souvent asymptomatique, le diagnostic est évoqué devant l’apparition d’un frottement péricardique.
Parfois, elle se traduit par une douleur thoracique majorée à l’inspiration, un pic fébrile, un susdécalage de ST diffus.
L’échocardiogramme précise l’abondance de l’épanchement péricardique mais celuici est inconstant.
La régression est habituelle en quelques jours soit spontanément soit après avoir majoré la dose d’aspirine.
La nécessité d’arrêter l’anticoagulation est contestée car la tamponnade est très rare.
• Le syndrome de Dressler est devenu exceptionnel.
De survenue tardive (au-delà du 15e jour de l’infarctus), son mécanisme est probablement immunologique.
Il réalise un tableau de péricardite aiguë souvent sévère avec pleurésie et arthralgies, régressif sous traitement antiinflammatoire prolongé.
7- Complications thromboemboliques :
• Les phlébites et embolies pulmonaires sont devenues rares depuis que le lever des patients se fait précocement et que tout infarctus est traité par un antithrombotique.
• Un thrombus pariétal au contact de la zone infarcie complique surtout les infarctus apicaux et ceux ayant évolué vers l’anévrisme.
Il expose à une embolie artérielle qui touche en priorité le territoire cérébral. Le diagnostic est fait par l’échocardiogramme qui retrouve au niveau de la zone akinétique (ou dyskinétique) un écho anormal plus ou moins mobile.
Sa découverte conduit à renforcer le traitement par l’héparine et à faire un relais par les antivitamines K.
8- Anévrisme du ventricule gauche :
Il réalise une poche dyskinétique, c’est-à-dire animée d’un mouvement d’expansion paradoxale en systole, qui complique plus souvent les infarctus apicaux que les infarctus inférieurs.
Il est la conséquence tardive d’un phénomène de remodelage précoce marqué (phase d’expansion).
Le diagnostic repose sur la persistance du susdécalage de ST au-delà du 15e jour, une voussure déformant l’arc inférieur gauche sur la radiographie de face et surtout l’aspect échographique de poche dyskinétique.
À ce stade de cicatrisation de l’infarctus, il n’y a pas de risque de rupture.
L’anévrisme expose à 3 types de complications : insuffisance cardiaque, troubles du rythme ventriculaire et embolies systémiques à partir d’une thrombose in situ.
L’insuffisance cardiaque mal contrôlée ou la survenue d’une TV/FV doivent faire envisager la résection chirurgicale de l’anévrisme après réalisation d’une coronarographie avec ventriculographie qui évalue la qualité et l’étendue du muscle restant.
La prévention des complications thromboemboliques repose sur le traitement anticoagulant au long cours.
Traitement de l’infarctus non compliqué :
Le traitement des 12 premières heures doit être centré sur la réouverture de l’artère responsable de l’infarctus en ayant recours soit à la thrombolyse intraveineuse soit à l’angioplastie.
En réduisant la taille de la nécrose, cette stratégie a diminué d’environ 50 % l’ensemble des complications et la mortalité.
1- Toutes premières mesures : elles comportent le repos strict au lit, l’installation d’une perfusion de glucosé 5 %, l’administration d’un antalgique (morphinique en cas de douleur très intense) et d’un tranquillisant, l’injection intraveineuse d’aspirine (250 à 500 mg).
2- Reperfusion coronaire :
• La thrombolyse intraveineuse diminue la mortalité lorsqu’elle est réalisée pendant les 12 premières heures de l’infarctus, à condition d’en respecter les contreindications.
L’effet bénéfique est d’autant plus important que la thrombolyse a débuté précocement.
Le gain absolu, exprimé en vies sauvées pour 1 000 patients traités, est d’environ 30 avant la 6e heure, 20 entre la 6e et la 12e heure, mais 65 dans la 1re heure.
D’où l’intérêt de développer la thrombolyse préhospitalière par le SAMU, qui permet de gagner environ une heure.
La baisse de la mortalité est d’autant plus nette que les patients sont à haut risque: localisation antérieure de la nécrose, bloc de branche, patient âgé, pression artérielle systolique < 100 mmHg, fréquence cardiaque > 100/min.
Le risque d’hémorragie grave directement lié à la thrombolyse est voisin de 1 % dont la moitié d’hémorragies cérébrales qui surviennent dans les 2 premiers jours.
Trois thrombolytiques peuvent être utilisés : la streptokinase et 2 activateurs du plasminogène, l’altéplase et le retéplase. L’altéplase est plus efficace que la streptokinase : il assure une perméabilité coronaire complète à la 90e minute chez 54 % des patients et permet de sauver 10 vies supplémentaires pour 1 000 patients traités avec cependant un AVC hémorragique en plus.
Le retéplase ne s’est pas montré supérieur à l’altéplase en terme de pronostic.
• L’angioplastie primaire a des avantages théoriques certains par rapport à la thrombolyse : taux de perméabilité coronaire plus élevé (90 %) à l’origine d’une réduction plus importante de l’étendue de la nécrose, traitement dans le même temps de l’occlusion thrombotique et de la sténose athéromateuse sous-jacente, diminution du risque hémorragique.
Elle améliore donc le pronostic.
Cependant, elle suppose une infrastructure lourde avec présence d’une équipe expérimentée disponible 24 heures sur 24.
En pratique, le choix entre thrombolyse et angioplastie doit se discuter au cas par cas en tenant compte des structures médicales existantes et de l’évaluation du rapport risque-bénéfice.
La décision d’angioplastie ne se discute pas en cas de contreindication à la thrombolyse ou de choc cardiogénique.
• L’angioplastie de sauvetage : cette stratégie a pour but de réaliser une coronarographie dans les suites immédiates de la thrombolyse et de faire une angioplastie si l’artère demeure occluse.
Elle se heurte à des problèmes d’ordre logistique mais a prouvé son efficacité dans les infarctus à risque (notamment localisation antérieure).
3- Traitements adjuvants :
• L’aspirine : sa prescription doit être aussi large que possible.
Une posologie faible (160 mg/j per os) suffit à réduire la mortalité, l’incidence des récidives d’infarctus et d’AVC.
Cet effet bénéfique s’ajoute à celui de la thrombolyse.
L’aspirine permet notamment de prévenir les réocclusion coronaires après thrombolyse.
L’association ticlopidine-aspirine est fondamentale lorsque l’angioplastie comporte la mise en place d’une endoprothèse coronaire.
• L’héparine : elle diminue la mortalité chez les patients non reperfusés.
En association avec la streptokinase, son intérêt reste controversé.
Par contre, avec le tPA et le reteplase, il faut associer d’emblée une héparinothérapie intraveineuse efficace pendant 48 heures, afin de prévenir les réocclusions précoces.
Il en est de même en cas d’angioplastie primaire.
• Les bêtabloquants : en l’absence de reperfusion, leur administration précoce en intraveineux avec relais immédiat per os réduit la mortalité, le risque de fibrillation ventriculaire et de récidive d’infarctus, à condition de respecter les contre-indications habituelles (asthme, oedème pulmonaire, hypotension, bradycardie ou bloc auriculo-ventriculaire).
Chez un patient thrombolysé, leur intérêt est plus difficile à démontrer.
Les meilleures indications à l’utilisation intraveineuse précoce (Ténormine, Séloken) sont la tachycardie sinusale, l’hypertension et la douleur résistant aux opiacés.
La prescription orale doit être aussi large que possible.
• Les inhibiteurs de l’enzyme de conversion de l’angiotensine (IEC) : Lopril, Rénitec, Triatec débutés tardivement au cours de l’hospitalisation améliorent nettement le pronostic des infarctus compliqués d’insuffisance cardiaque ou de dysfonction ventriculaire gauche isolée (FE o 40 %).
L’effet bénéfique est plus discret lorsque l’IEC est administré dès le premier jour dans l’infarctus tout venant, non sélectionné.
Compte tenu du risque d’hypotension artérielle sévère, qui s’ajoute à celui des autres médicaments administrés, la prescription d’un IEC dès le premier jour ne doit pas être systématique.
Dans tous les cas, on débutera par une posologie faible en augmentant progressivement les doses.
• Les dérivés nitrés : leur intérêt n’a pas été formellement démontré.
Leur utilisation précoce par voie intraveineuse pendant 48 heures reste habituelle, au moins dans un but antalgique, à condition d’utiliser une posologie faible (trinitrine 10 à 20 eg/min), et de surveiller la tolérance tensionnelle.
Rien ne justifie de prendre le relais par la voie orale ou transdermique s’il n’y a pas eu de récidive ischémique ou d’insuffisance cardiaque.
• Le magnésium intraveineux : son utilisation systématique reste très controversée.
Son intérêt résiderait dans la prévention des lésions myocardiques liées à la reperfusion, ce qui suppose de l’administrer de façon très précoce.
• Certains médicaments peuvent être délétères en prescription systématique : c’est le cas notamment des inhibiteurs calciques et de la Xylocaïne.
4- Ordonnance de sortie :
Elle repose sur 4 médicaments fondamentaux qui ont tous prouvé leur efficacité sur le pronostic du postinfarctus : aspirine (100 à 300 mg/j), bêtabloquant, IEC s’il existe une dysfonction ventriculaire gauche (fraction d’éjection < 40 %), statine (Zocor, Vasten) si le taux de LDL-cholestérol est > 1,3 g/L.
La trinitrine sublinguale (spray ou dragée à croquer) doit toujours être à portée de main pour traiter une récidive angineuse. En cas d’allergie à l’aspirine, on pourra proposer la ticlopidine (Ticlid) ou les antivitamines K.
Le vérapamil (Isoptine) peut être prescrit en cas de contre-indication aux bêtabloquants, à condition que la fonction ventriculaire gauche soit conservée.
La correction des facteurs de risque est primordiale, notamment l’arrêt du tabagisme.
Une réadaptation cardiovasculaire (gymnastique, bicyclette ergométrique) est souhaitable.





